|
 |
Kitaplar » Su Ürünleri Yetiştiriciliği » Mikro Alg Üretimi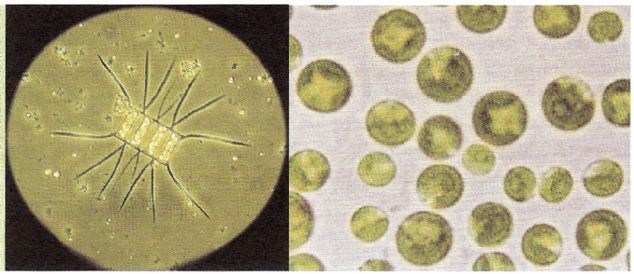 Mikroalg kültüründe önemli oaln pek çok alg türü bulunmaktadır. Solda Chaetoceros sp. Sağda Chlorella sp. MİKROALG (FİTOPLANKTON) YETİŞTİRİCİLİĞİ Mikro alg yetiştiriciliği çeşitli amaçlarla ele alınan bir konudur. Özellikle çeşitli su canlılarının ilk dönemdeki beslenmesinde mikro alg- lerin çok büyük önemi vardır. Örneğin karides larvası üretiminde ilk başlangıç yemi olarak algler vazgeçilemeyecek bir gıda kaynağıdır. Bu nedenle dünyada milyarlarca yetiştirilen karides larvası üretimi için bu larvaları besleme amacıyla yoğun alg üretimi yapılır. Bunu yanında balık larvalarına canlı yem olarak kullanılan rotifer yetiştiriciliğinde de rotiferlere yem olarak alglerin üretimi de önemli bir konudur. Bunun yanında alglerin pek çok diğer kullanım alanları vardır. Bunlardan bazıları insan gıdası olarak kullanıla- bildiği gibi yan bir besleyici olarak hap şeklinde insanlara sunumu da söz konusudur. Kimya ve kozmetik dünyasında da çeşitli algler kullanılmakta ve bu amaçla yoğun yetiştirme çalışmaları uygulanmaktadır. Alg üretimi konusunda çok çeşitli besi yöntemleri ve formülleri geliştirilmiş olmakla beraber biz konumuz kapsamında olan deniz balıkları larvası yetiştiriciliğinde kullanılan rotiferlerin beslenmesinde uygulanan mikro alg yetiştirme yöntemlerine değinerek konuyu aydınlatmaya çalışacağız. Daha geniş kapasitelerde yetiştirme söz konusu olduğunda uygulanacak yöntemler de genel olarak benzerdir. Bu nedenle bu konuda yeterli bilgiyi verebileceğimiz düşüncesi ile Tarım Bakanlığı'nın Karadeniz'de kalkan yetiştiriciliği kapsamında uyguladığı alg yetiştirme yöntemini tam açıklığı ile vererek konuyu ihtiyaç duyacaklara sunmaya gayret edeceğiz. Kuluçkahanelerde veya diğer amaçlarla yapılacak mikro alg üretimlerinde detayları çok güzel bir şekilde açıklanmış olan bu çalışmanın alg üretimi ile ilgilenenlere önemli bir yol gösterici olacağına inanıyorum. Diğer deniz balıkları kuluçkahanelerinde olduğu gibi, Kalkan balığı larva yetiştiriciliğinde de, fitoplankton üretimindeki amaçlar; rotiferlerin beslenmesi, rotifer ve artemia larvalarının besin değerini yükseltme amacıyla yapılan alg ile besleme çalışmaları, ayrıca larva tanklarında pestisit ve amonyak gibi zararlı maddelerin ortadan kaldırılması için alglerden yararlanma olarak sıralanabilir.
Hızlı gelişme safhası: Hücreler düzenli ve sürekli olarak sabit bir oranda bölünmeye başlamaktadır. Bu aşamada gelişme oranı maksimum seviyededir. Yavaş gelişme safhası: Bu aşama hızlı çoğalma ve durgunluk safhaları arasındaki gelişmenin yavaşladığı safhadır. Bu safha diğer kültür tankına ekim yapılma zamanı olarak tavsiye edilmektedir. Duraklama safhası: Hücrelerin çoğalma ve yok olma oranlarının eşit olduğu bu evrede, hücre sayısında herhangi bir değişme olmamaktadır. Çökme Safhası: Bu safhada hücre sayısı ani olarak azalmaya başlar. Bu safhada ki fitoplankton, larva veya rotifer kültürü için kullanılmamalıdır.
  Üst:Alg üretiminde cam pipetler içerisinde başlayan üretim çalışmaları büyük tanklarda sone erer. Alt:küçük kaplarda devan eden alg üretim çalışmaları Proje başlangıcında Nannochloropsis sp. ve Phaeodactylum sp. türlerinin stok kültürleri ]aponya'dan getirilmiş ve Dunaliella sp., Cblorella spp., Chaetoceros sp. ve Skeletonema costatum türleri Türkiye sularından izole edilerek stok kültür oluşturulmuştur. Yapılan denemeler sonucu yoğun üretimde kullanılacak aday tür olarak Nannochloropsis sp. ve Phaeodactylum sp. seçilmiştir. Rotiferin küçük ölçekli hacimlerde üretim safhasında beslenmesi amacıyla Tetraselmis sp. kültürü de ele alınmıştır. Optimum sıcaklıklarda (200C ve 12.5°C) Nannochloropsis sp. ve Pbaeoductylum sp. türlerinin yoğunluğu ekimden (inokülasyon) bir hafta sonra sırasıyla 20x106 ve 2x106 hücre/ml'ye ulaşır. Uygulanan alg kültür prosedürü iki aşamadan oluşur: Üretilen alg türü için uygun büyüme koşullarını sağlayabilmek amacıyla stok kültür odasının sıcaklığı klima ile 18-220C arasında tutulur. Fotoperiyot veya gün uzunluğu, doğal gün ışığı tipi (2000-3000 lüks) floresan lambalar kullanılarak 12 saat aydınlık ve 12 saat karanlık olacak şekilde kontrol edilir. Cam malzemeler bir gece boyunca fosfor içermeyen deterjanda tutulur, iyice fırçalanarak yıkanır ve daha herhangi bir deterjan kalıntısı kalmayacak şekilde iyice durulanır. Bu işlemden sonra malzemeler 0.1 N HCI'lik asit solüsyonunda yıkanır ve saf su ile durulanır. Daha sonra kurumak üzere tozsuz bir yere ağızları aşağı gele- Arzu edilmeyen organizmaların kontaminasyonunu önlemek için, kültür kapları kullanılmadan önce otoklav veya etüv kullanılarak steril edilmelidir. (Otoklavda sterilizasyon 2 atm basınç ve 121•C'de 15 dakika) Steril edilecek materyaller alüminyum folyo veya gazete kağıdı benzeri materyalle sarılarak otoklav içerisine tüm yüzeye buhar ulaşacak şekilde yerleştirilir. Kimyasal kontaminasyondan sakınmak için otoklavın su haznesinde saf su kullanılmalıdır. Sterilizasyon işlemi sırasında oluşan yüksek basınç sonucu oluşabilecek patlamalardan kaçınmak için kapların ağızları tam olarak kapatılmamalı hafif bir hava akımı sağlayacak boşluk bırakılmalı veya pamuk gibi malzemelerin üzeri alüminyum folyo ile kapatılarak hava girişi sağlanmalıdır.  Alg örnekleristeril ortamda stoklanır ve gerektiğinde buradan alınan örnekler üzerinden çoğaltılır
ETÜVDE STERİLİZASYON (KURU ISI) Kapların etüvden çıkarıldıktan sonra da iç kısımlarının steril kalmalarını sağlamak amacıyla boyun ve ağız kısımları alüminyum folyo ile kaplanır ve en az iki saat süre ile 160-180oC Küçük hacimlerde geliştirilecek olan kültür için Walne veya f/2 stok solüsyonu formülasyonuna göre saf kimyasallar kullanılarak bir besi ortamı (medyurn) hazırlanır. Stok kültür için kullanılacak deniz suyu, kullanılmadan birkaç ay önce fiberglas filtreden (Whatman GF/C) geçirilerek muhafaza kaplarında tutulur. Bu dinlerıdirilmiş deniz suyu daha sonra küçük hacimli kültür ortamlarına dağıtılır ve otoklavda steril edilir. Minarellerin çökelmesini önlemek amacıyla deniz suyu ve besi ortamı ayrı ayrı steril edilir ve daha sonra steril şartlar altında karıştırılır. Kültürün küçük hacimlerden büyük hacimlere çıkarılması safhasında olası kontarninasyon riskini minimuma indirmek amacıyla test tüp kültürü dışında "parti kültür sistemi" adı verilen süreç kullanılır ve hiçbir zaman bir defadan fazla ekim yapılmaz. TEST TÜPLERİNDE ALG KÜLTÜRÜ Bu izolasyon işlemi için, içerisinde LO ml stok besi ortamı bulunan 20 kadar test tüpünün her birine steril pastör pipetle izole edilecek stok kültürden iki damla inokülasyon (ekim) yapılır. Stok kültürün saflığı, ortamın şeffaflığı, içerisinde topaklanmanın olmaması ve hızlı gelişme gibi parametrelere göre değerlendirilir. Ayrıca mikroskop altında incelenen örnekteki hücre büyüklüklerinin homojen olması da kültürle ilgili iyi bir göstergedir. Ekimi yapılan test tüplerindeki kültürler 200 ml'lik daha büyük hacimlere transfer edilmeden önce iki-üç hafta gelişmeleri sağlanır. Alg hücrelerinin test tüplerinin dip kısımda çökelmesini engellemek için, her gün dikkatli bir şekilde çalkalanmalıdır. Stok kültürün seçiminden sonra, kalan diğer temiz stoklar 2- 4°C'de üretim sezonundaki iş yoğunluğunu azaltmak amacıyla buzdolabında muhafaza edilir. Bu stoklar haftada bir kez çalkalanır. Şayet stoğun yüksek kondisyonu sürdürülebilirse, buzdolabında altı ay muhafaza edilebilir.
200 ml HACİMLERDE ALG KÜLTÜRÜ
 Naylon torbalarda alg üretimi yoğun olarak yapılır. Koyu renkli olanlar alg gelişiminin sınırına yaklaşmış olan üretimleri göstermektedir BÜYÜK HACİMLERDE 000 i 'den 1 mve) ALG KÜLTÜRÜ
Deniz suyunun dezenfeksiyonunda kullanılan çamaşır suyu (klorin), bunun nötralizasyonu ve Nannochloropsis ve Phaeodactylum kültürleri için kullanılacak gübre oranları Tablo 2'de özetlenmiştir.
Yoğun alg üretimi, bina dışına yerleştirilen 5-30 m3 hacme sahip fiberglass tanklarda yapılmaktadır. Fitoplankton gelişimini hızlandırmak için tanklar güneş ışınlarını direkt alabilecek şekilde yönleri doğudan batıya doğru olarak yerleştirilmelidir. Tanklar rotifer ve diğer protozoaların kuvvetli rüzgar veya diğer herhangi bir şekilde kontaminasyon riski göz önüne alınarak yerleştirilmelidir.
 Alg üretim tankları Yoğun üretim tanklarında, verilecek olan gübrenin oranı ve veriliş sıklığı kültürün gelişimini kontrol ettiğinden, Tablo 2'de de görüldüğü gibi standart gübrenin üçte biri, üç günde bir olmak üzere tanklara verilir. Hedeflenen yoğunluğa ulaşan alg kültür, rotifer beslemede veya muhafaza amacıyla konsantre edilmeden önce sıcaklığı kontrol edilebilen tanklara transfer edilir. AIg kültürünün bir tanktan diğerine nakli spiral hortum takılmış olan dalgıç pompalarla yapılmaktadır. Bu işlem sırasında hortumun ucuna yerleştirilen 45 mikronluk plankton kepçesi ile alg filtre edilir. HÜCRE SAYIMI: Fitoplanktonun hücre sayımı biyolojik mikroskop altında sayım kamarası (hemasitometre) kullanılarak yapılır. Sayım karnarası ortasında kalın dikdörtgen veya H şeklinde sayılacak fitoplankton hücrelerinin yerleştirileceği dairesel girintiler içerir. Kamaranın tipine göre derinliği 0.1 mm olan bir odacık oluşturan bir veya iki sayım alanı bulunur. Sayım amacıyla her bir kültür tankından alınan üçer örnek iyice karıştırılır. Pastör pipet kullanılarak örnekten bir damla sayım kamarasındaki odacığa tespit edilir. Örneğin sayım odacığına yerleştirilmesinde aşağıdaki hususlara 'Sayım kamarası temizlenir ve %90'lık alkol içerisine konur. Kesinlikle toz ve yağdan arındırılmalıdır. . Lamel sayım kamarasının ölçümlendirilmiş (cetvelli) kısmına yerleştirilir. 'Bir damla örnek (lamelin karşılıklı kenarlarına kadar yayılacak miktarda) lamelin üstüne damlatılarak sayım odacığının içerisine girmesi sağlanır. 'Örnek taşmaya sebep olacak kadar fazla veya sayım odacığını tam doldurmayacak kadar az olmamalıdır. -Petri kutusunun içerisine Örneğin buharlaşmasını önlemek için bir parça ıslak kağıt yerleştirilir. Sayım kamarası petri içerisine konarak hücrelerin çökmesi için 5 dakika bekletilir. Fitoplankton sayımında yaygın olarak, ölçümlendirme ve ebatlarına göre üç tip kamara kullanılmaktadır. Thoma tip sayım kamarasında en büyük karenin ebatları 1 mm x 1 mm' dir. Burker-Turk tipinde 3 mm x 3mm ve Neubauer Bu sayım odacığı büyük, orta ve küçük karelere sahiptir (Şekil 3 A, B ve C). Büyük karenin alanı (Şekil 3 A) Imm x Imm'dir. Büyük bir karede genellikle 16 veya 25 orta büyüklükte kare (Şekil 3 B) bulunurken, orta büyüklükte bir kare de 25 adet küçük kareye (Şekil 3 C) sahip.tir. Rastgele 5 tane orta (B) büyüklükte kare seçilerek, bu karelerde kalın çizgilerle çevrelenmiş olan alan içerisinde kalan tüm hücreler mikroskop altında 200-400 kez büyütülerek sayılır (Şekil 3). Eğer kültürün hücre yoğunluğu düşük ise büyük kare (A) içersindeki tüm hücreler sayılır. Sayımı yapılan kareyi çevreleyen üst ve sol kenar çizgisine dokunan hücreler sayılırken, alt ve sağ kenar çizgisine dokunanlar sayılmaz.  büyük havuzlar içerisinde alg üretimi -Orta büyüklükteki S karede sayılan toplam hücre sayısı: NI + N2 + N3 + N4 + N5 • Buna göre fitoplankton hücre yoğunluğu (hücre/ml) aşağıdaki şekilde hesaplanabilir
Mikroskobik incelemenin yanı sıra günlük olarak her kültür tankı görsel olarak da kontrol edilmelidir. Kültür tankının yan duvarlarında kirlenme veya su yüzeyinde koyu yapışkan yeşil baloncuklar oluştuğu gözlenirse rotifer kontaminasyonu veya protozoa üremesinden şüphelenilmelidir. Bu gibi durumlarda, 1 ml kültür örneği stereomikroskop altında incelenmelidir. Herhangi bir kontaminasyon belirtisine rastlanmaması c.KÜLTÜRÜN KONSANTRE EDİLEREK MUHAFAZASI
|